Bioquímica
13:49:00CONCEPTES BÀSICS DE LA BIOQUÍMICA
Definicions:
-
Ciència que estudia la vida
fent servir el llenguatge de la química.
-
Part de la química que estudia
la composició i les transformacions químiques dels organismes.
-
Ciència que estudia els éssers
vius a nivell molecular mitjançant tècniques i mètodes físics, químics i
biològics.
Classificació
de la bioquímica:
- Bioquímica estàtica: estructural
- Bioquímica dinàmica: metabòlica
- Biologia molecular (genètica molecular)
BIOELEMENTS: elements químics que formen part dels éssers vius, tant en forma atòmica
com formant part de les biomolècules. Constituïdes per C, N, O i H.
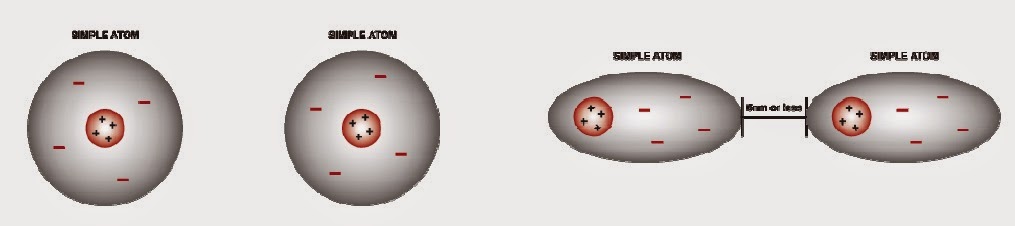
L’àtom és la unitat més petits i indivisible. Esta format per un nucli on trobem els
protons i els neutrons, i orbites on hi ha els electrons.
X → és el símbol de
l’element químic
A → número anatòmic i
determina el número de protons
Z → massa atòmica i determina el número de
protons i electrons
Segons el número d’electrons determina l’estat iònic de
l’element químic.
-
Neutre: protons = electrons
-
Catió (carregat positivament): protons > electrons
-
Anió (carrega negativa): protons < electrons
A la taula periòdica podem trobar tots els diferents elements químics i els
elements químics estan ordenats en funció del número atòmic.
Classificació
segons abundància:
Elements primaris (96,2%): C, H, O, N, P i S
Elements secundaris (0,7%): Ca, Cl, K, Na Mg, Fe...
Elements oligoelements (0,1%): Mn, Zn, I, Cu, Co, Al....
Classificació segons els compostos
químics que formen la matèria viva:
Inorgàniques:
Aigua, gasos (oxigen i diòxid de carboni) i sals minerals.
Orgàniques: Hidrats
de carboni, lípids, proteïnes, àcids nucleics.
ENLLAÇOS QUÍMICS
Enllaços intramoleculars
Enllaç covalent: forca electromagnètica que
mante units àtoms que comparteixen electrons. Els àtoms enllacats son neutres i
generalment son no metàl·lics. Són unions fortes entre àtoms. Baixa relació
espacial (angles i distancies) i l’energia de formació: -50 a-100 Kcal/mol.
Polaritat dels enllaços covalents:
Segons on estigui situat l’element químic de la
taula esta carregat més o menys electronegativament.
Ex: O > N >
C > H
Per tant la unió de:
C-C, O-O, N-N, H-H, C-H, N-O → no polars
(hidrofòbiques)
H-O, N-H, C-O →polars (hidrofiliques)
D’aquesta manera quan es produeix un enllaç covalent
l’element químic que té carrega parcial negativament atrau amb més força
l’electró de l’element que té parcialment carrega positiva.
Ex: δ- O ←: δ+ H δ carrega parcial
Tipus d’enllaços covalents:
-
Enllaç simple: comparteix 2
electrons.
-
Enllaç doble: comparteix 4
electrons
-
Enllaç triple: comparteix 6
electrons
Al voltant d’un enllaç
simple sempre esta permès el gir, cosa que no passa amb els enllaços dobles o
triples.
Pont disulfur: enllaç covalent amb la unió de dues molècules de sofre (-SH).
Enllaç peptídic: enllaç covalent que uneix les aminoàcids per formar proteïnes.
Enllaç iònic: atracció electrostàtica que existeix entre els ions de cargues oposades
(cations – anions). Transferència d’un o més electrons, generalment del metall
cap al no metall. I també, formació d’un enllaç iònic per proximitat entre un grup àcid (carregat
negativament) i un grup amino (carregat positivament).
Característiques: Sòlids
d'estructura cristal·lina. Alts punts de fusió i ebullició. Solubles en agua i
altres dissolucions aquoses. En estat sòlid no condueixen l’electricitat. Una
vegada fosos o en solució aquosa si que condueixen l’electricitat.
Enllaços intermoleculars
Ponts d’hidrogen: atraccions electrostàtiques entre un hidrogen que porta
una carrega parcial positiva i un altre àtom (normalment O o N) que tingui una
carrega parcial negativa.
Característiques:
Sempre intervé una
molècula d’H. L’enllaç tendeix a ser lineal. Poden tenir una longitud superior
a la dels enllaços covalents. En alguns casos també poden ser enllaços
intramoleculars. Son mes dèbils que els enllaços covalents i tenen menys
energia.
Ponts d’hidrogen en la molècula
d’aigua i entre les bases nitrogenades del DNA.
Forces de Van der Waals: interaccions elèctriques
dèbils i transitòries d’uns àtoms per altres.
Característiques:
Naturalesa purament
electrostàtica (atracció / repulsió). Son els enllaços mes dèbils (0,5-1
kcal/mol). Tenen una gran importància en l'estructura proteica.
I també, les forces de Van der Waals fan interaccions que
es produeixen per fluctuacions en la carrega
dels àtoms.
Enllaços
hidrofòbics: tendència de les molècules no polars a interaccionar
entre si enlloc d’interaccionar amb l’aigua.
Característiques:
proteïnes per falta
d’interacció entre les cadenes laterals dels aminoàcids hidròfobs. Son els
enllaços més dèbils. Tenen una gran
importància en l'estructura proteica, ja que, afavoreixen el plegament de les
proteïnes donant lloc a l’estabilització de l'estructura terciària.
BIOMOLÈCULES: unió d’elements químics formant una molècula.
Esquelets
de les molècules orgàniques
Els àtoms de
carboni units entre si per enllaços covalents formen l’esquelet de les principals
molècules orgàniques.
Grups
funcionals: àtom o grup d’àtoms que li confereixen a una biomolècula característiques
especials.















0 comments